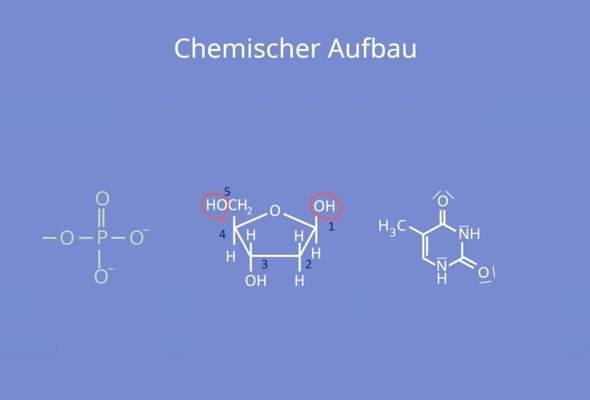
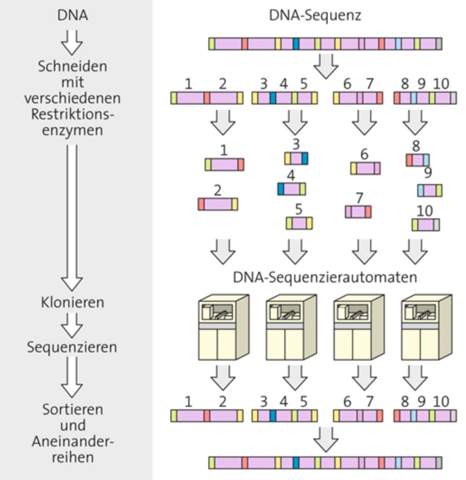
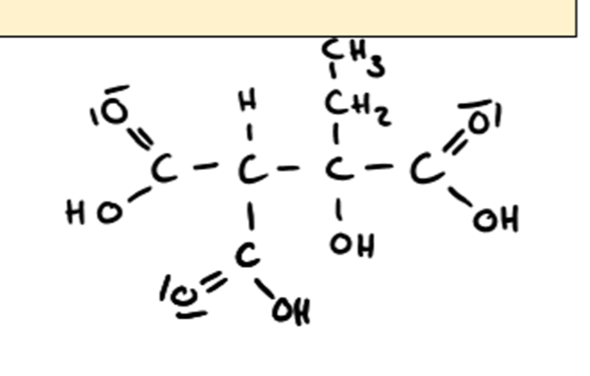
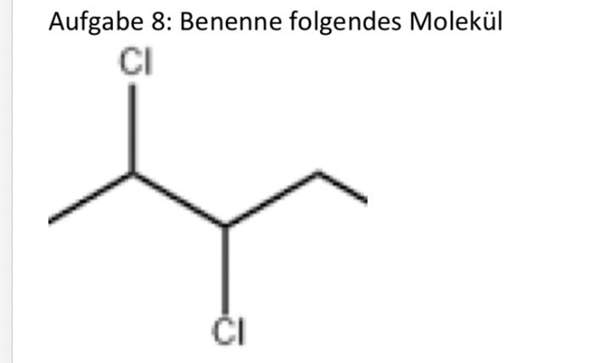
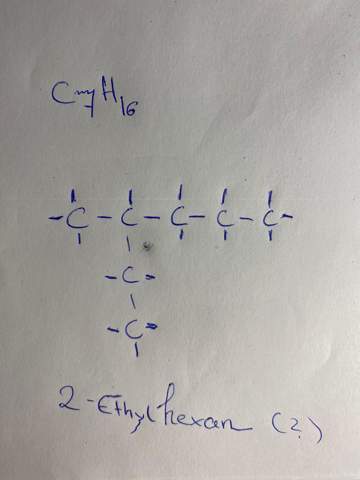
"Das Enantiomer, das Enantiomer - das macht einem das Leben manchmal schön schwer"
Folgendes soll gezeichnet werden:
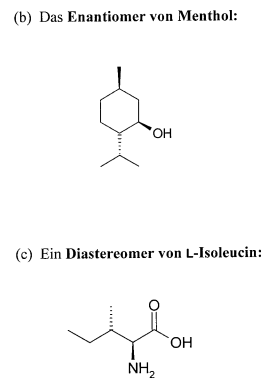
zu b) Ich weiß, daß man beim Enantiomer das Chiralitätszentrum rausfinden muss und dann die Chiralitätszentren auf die andere Seite "flippen". Menthol hat 3 Chiralitätszentren
So jetzt hätt ich gedacht, man flippt das OH auf die andere Seite und diese C-H3C-Ch3 und CH3. Jetzt wird aber im Internet nur OH auf die andere Seite geflippt und der Rest bleibt Warum?
Außerdem triggert es mich, daß es hier zwei Enantiomere gibt. Ich dachte es gibt immer nur eines.
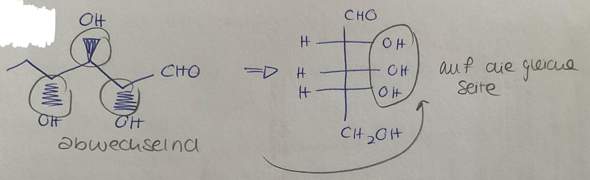
zu c): Hier haben wir gelernt dass man bei den Diasteromeren, analog zum Enantiomer, wieder die Chiralitätszentren sucht und dann wieder eine Bindung auf die andere Seite "flippt". Mein Vorschlag wäre jetzt einfach das "NH2" am 2. Kohlenstoff-Atom von rechts aus betrachtet von unten nach oben zu "flippen". Tja, denkste. Denn im Internet steht foglendes:
Jetzt muss ich ein bisschen weinen, denn hier hat man einmal aus dem gestrichelten CH3 ein fettes CH3 gemacht und beim anderen Mal das CH3 dann noch mit dem NH2 vertauscht. Je ne sais pas pourquoi.
Ach ja, und falls sich jemand fragt woher wir diese "Beim Enantiomer flippt man alle steroisomeren Zentren und beim Diasteromere nur eins"-Regel haben. Die steht im Buch "Organical Chemistry For Dummies" von Arthur Winter auf S. 96
Kann natürlich auch sein, daß wir das in den falschen Hals bekommen haben und die Regel "Enantiomer => Alle Chiralitätszentren flippen Diastomere:=> Nur eins flippen" der totale Mist ist.
Liebe Grüße und noch einen wunderschönen sonnigen Montagabend,
Jens Erdkunde 8.1 Jahr